“黑馬”歌禮終于“出線”了。
今天(6月13日)歌禮宣布,其開發(fā)的抗丙肝1類創(chuàng)新藥戈諾衛(wèi)(達諾瑞韋,又名丹諾瑞韋、ASC08)獲得國家藥品監(jiān)督管理局批準上市。
距離其2017年1月提交上市申請,1年零5個月。
戈諾衛(wèi)是歌禮獲批上市的品種,也是由中國本土企業(yè)開發(fā)的直接抗病毒藥物(DAA),為十三五國家科重大專項“重大新藥創(chuàng)制”專項立項支持品種。但,它必須面對的現(xiàn)實是:吉利德索磷布韋(吉一代)、丙通沙(索磷布韋維帕他韋片),艾伯維的維建樂(奧比帕利片)、易奇瑞(達塞布韋鈉片)等進口DAA藥物已紛紛進入中國市場,丙肝藥市場競爭已日趨白熱化。
盡管如此,歌禮和業(yè)界還是很有信心。據(jù)歌禮預估,戈諾衛(wèi)上市后2018年銷售額可達5億元;而業(yè)內(nèi)人士則普遍認為,以不輸進口藥的品質(zhì)和更符合國情的價格,未來本土抗丙肝藥將成為中國市場的主流上市的戈諾衛(wèi)已毫無疑問地搶占先機。

戈諾衛(wèi)的上市,將是歌禮沖刺IPO的有力背書。
5月7日,歌禮生物科技正式向港交所遞交了IPO申請書,成為個未盈利而沖刺IPO的生物醫(yī)藥企業(yè)。而這得益于港交所4月30日生效的IPO新規(guī)——允許雙重股權(quán)結(jié)構(gòu)公司、尚未盈利的生物科技公司赴港上市。
雖然新規(guī)提出了嚴苛的要求,如:相關(guān)企業(yè)必須有最少一名資深投資者作出相當數(shù)額的投資;擬上市公司預期市值不能低于15億港元;從事核心產(chǎn)品研發(fā)至少12個月,核心產(chǎn)品臨床試驗已經(jīng)進入第二期或者第三期等。但,從“履歷”上看,成立于2013年的歌禮,完全符合。
其創(chuàng)辦人兼行政總裁吳勁梓,2008年至2011年間在美國葛蘭素史克出任HIV藥物發(fā)現(xiàn)執(zhí)行部門副總裁,主要負責多種臨床前及臨床階段在研藥物的發(fā)現(xiàn)和開發(fā);且先后經(jīng)歷多輪融資,市場認為,目前歌禮估值或近百億元。
2015年9月,獲得天士力集團旗下子公司天士力(香港)藥業(yè)有限公司與康橋資本共同投資的3500萬美元首輪融資;
2015年12月,獲得了高盛集團2000萬美元的投資。A輪融資金額達5500萬美元。
2017年1月3日,完成1億美元B輪融資。由康橋資本領投,前海股權(quán)投資基金、分眾傳媒江南春基金會、蔡氏家族投資公司跟投,A輪資方高盛集團、天士力集團繼續(xù)跟投。
雖然歌禮目前還未實現(xiàn)盈利。從其招股說明書看,2017年,該公司虧損為1.3億元,其中研發(fā)成本1.1億元,占比80%;2016年虧損676.1萬元,研發(fā)成本為6268.9萬元。但,其核心產(chǎn)品卻足以給市場和行業(yè)極大信心。

此次獲批上市的戈諾衛(wèi),是歌禮開發(fā)的具有自主知識產(chǎn)權(quán)的新一代NS3/4A蛋白酶抑制劑,試驗結(jié)果證明
在中國大陸地區(qū)完成的III期臨床試驗結(jié)果顯示,經(jīng)過12周治療,在基因1型非肝硬化患者中(SVR12)97%。
在中國臺灣、歐美、泰國、韓國等國家和地區(qū)完成了多個臨床試驗。數(shù)據(jù)顯示,在基因1型肝硬化患者中的達91%;在基因4型非肝硬化患者中的達100%。
體外研究顯示,對基因1-6型的NS3/4A蛋白酶表現(xiàn)出強效活性。
而除戈諾衛(wèi)外,歌禮開發(fā)的另一個抗丙肝1類創(chuàng)新藥拉維達韋(新一代全基因型NS抑制劑)也已完成II / III期臨床研究,計劃于2018年第三季度遞交新藥上市申請。據(jù)悉,該產(chǎn)品聯(lián)合戈諾衛(wèi)組成的中國原研全口服無干擾素方案,在基因1型非肝硬化患者中(SVR12)達99%,且針對基線發(fā)生NS耐藥突變的患者,100%實現(xiàn)SVR12。
歌禮在招股說明書中表示,所募集資金中將有約30%用于核心產(chǎn)品線的持續(xù)研發(fā),25%用于戈諾衛(wèi)及拉維達韋商業(yè)化。
分析人士指出,在鼓勵藥械創(chuàng)新的大環(huán)境下,重視創(chuàng)新研發(fā)的企業(yè)也將迎來市場利好,近日突破3000億市值的恒瑞醫(yī)藥和一回歸A股即迅速突破千億市值的藥明康德,都是鮮活的例子。未來,將有越來越多的本土創(chuàng)新型醫(yī)藥企業(yè),復制它們的成功,為市場提供越來越多的新藥。

接近100%的也在壓縮市場,使競爭更加白熱化。
數(shù)據(jù)顯示,吉利德的索磷布韋2013年上市后,丙肝藥市場在經(jīng)歷了2014年、2015年的激增之后,2016年、2017年連續(xù)兩年,市場規(guī)模已下降至189億美元、125億美元。
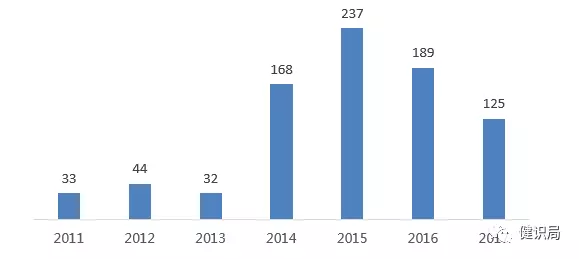
來源:醫(yī)藥魔方
而由于新藥審評審批速度較慢等原因,遲遲無丙肝DAA類藥物上市的中國,反而成了各方爭相布局的“藍海”。
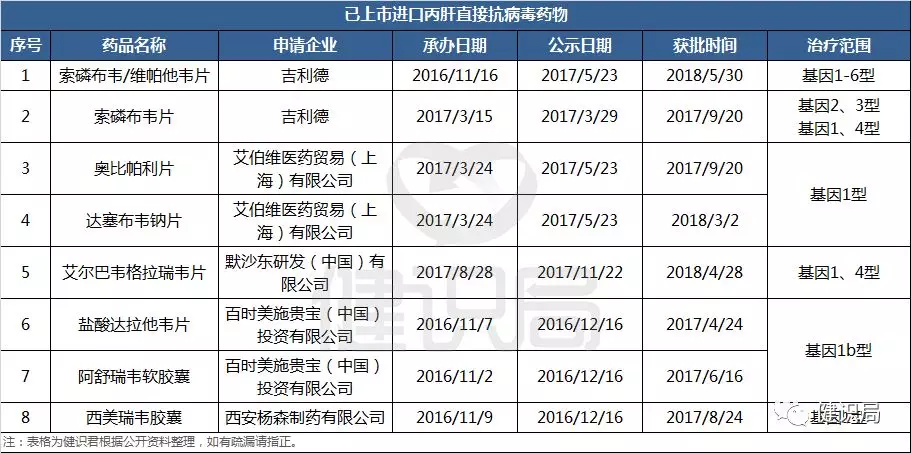
就在半個月前(5月30日)吉三代(吉利德的丙通沙,化學名:索磷布韋維帕他韋片)在我國獲批上市,這也是國內(nèi)獲批上市的泛基因型丙肝DAA藥物。而除此以外,已有7個丙肝DAA藥物在我國上市,且都是進口品種。
另據(jù)健識君統(tǒng)計,截至目前國家食藥監(jiān)管總局藥品審評中心(CDE)納入優(yōu)先審評審批的29批目錄中,仍有14個丙肝DAA藥品種未獲批上市,包括11個國產(chǎn)品種和3個進口品種。
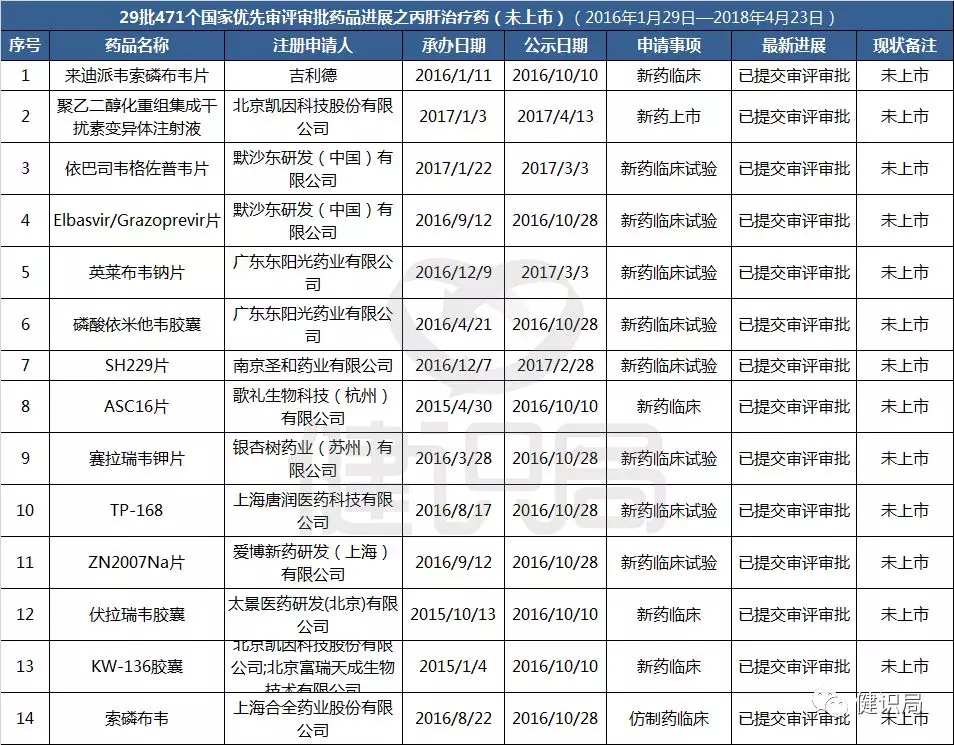
綠色通道之外,歌禮開發(fā)的另一個具有競爭力的抗丙肝1類創(chuàng)新藥拉維達韋(新一代全基因型NS抑制劑)也將很快遞交上市申請。
而從上市時間上看,即便這次上市的國產(chǎn)品種戈諾衛(wèi),較之個在國內(nèi)上市的進口丙肝DAA藥物——施貴寶的鹽酸達拉他韋片,也晚了一年多。雖然,市場尚未瓜分完畢,但國產(chǎn)品種的競爭壓力卻可想而知。更何況,在政策、市場的多重鼓勵下,還將有越來越多的DAA藥物將上市?
所幸,國產(chǎn)DAA藥物還有價格優(yōu)勢。歌禮創(chuàng)始人、董事長、總裁吳勁梓博士也曾表態(tài),“戈諾衛(wèi)的成功上市,實現(xiàn)了歌禮為中國患者提供可負擔的創(chuàng)新藥物的承諾”。
去年11月,吉利德公布了吉一代(索磷布韋)在華售價為19660元/瓶(規(guī)格:28片/瓶),以一個療程12周算,需要58980元。另據(jù)相關(guān)媒體報道,達卡他韋價格在2萬元左右/療程。也就是說,索磷布韋+達卡他韋的治療方案,1個療程的費用約為8萬元。雖然較之美國的售價已有大幅度降低,但對國內(nèi)低收入人群而言還是一筆不小的開銷。
分析人士認為,通過國家談判、醫(yī)保支付改革等手段,以及市場的充分競爭,進口藥價會有進一步降低的可能,但從現(xiàn)階段看,質(zhì)量、療效不輸進口藥,且價格更符合國情的國產(chǎn)藥,仍有望后來居上,占據(jù)市場。
來源: 健識局 原創(chuàng):木木
本文為轉(zhuǎn)載,我們不對其內(nèi)容和觀點負責。








