您現在的位置: 百濟新特藥房網首頁 >> 腫瘤科 >> 腫瘤常規用藥及解答
替莫唑胺-惡性腫瘤腦轉移的診治進展
- 來源: 中國醫學論壇報 作者:百濟動態 瀏覽: 發布時間:2008/2/21 16:26:00
浙江大學醫學院附屬邵逸夫醫院腫瘤內科 潘宏銘 諸靜文 金偉
腦轉移(Brain metastasis)是惡性腫瘤治療失敗的常見原因之一,通常臨床處理比較困難。實體瘤腦轉移患者的數量是原發性腦瘤的10倍。大約20%~40%的癌癥患者發生腦轉移,意味著每年美國大約有80,000~170,000例新診斷腦轉移瘤。而歐盟的腦轉移瘤相應發病人數高達210,000。
本文闡述實體瘤腦轉移發生的現狀、臨床表現、診斷和鑒別診斷,實體瘤腦轉移臨床處理的一般原則和個體化策略,腫瘤腦轉移治療的新進展。
一、 腦轉移的臨床表現
實體瘤腦轉移的主要臨床表現如下:(1)頭痛:性質多較劇烈,常在清晨發作,有時在睡眠中被痛醒,但起床輕度活動后頭痛就會逐漸緩解或消失。(2)嘔吐:由于顱內壓力的增高,致使延髓呼吸中樞受到刺激,從而出現嘔吐,嘔吐多在頭痛之后出現,呈噴射狀。(3)視力障礙:顱內壓增高時會使眼球靜脈血回流不暢,導致淤血水腫,損傷眼底視網膜上的視覺細胞,致視力下降。(4)精神異常:位于大腦前部額葉的腦瘤可破壞額葉,引起興奮、躁動、憂郁、壓抑、遺忘、虛構等精神異常表現。(5)單側肢體感覺異常或無力:頂葉專管感覺,該部位腫瘤常會導致單側肢體痛覺、溫覺、震動覺、形體辨別覺減退或消失。(6)幻嗅:顳葉部腫瘤可在其刺激下出現幻嗅,即可聞到一種并不存在的氣味,如燒焦飯或焦橡膠等氣味。(7)偏癱或踉蹌步態:腦干或小腦部位病變更具特異性,即患者常在頭痛、嘔吐、視物障礙之后,出現偏癱或踉蹌的醉酒步態。(8)耳鳴、耳聾:此種多在打電話時發覺,即一耳能聽到,另一耳則聽不到。該表現多是聽神經瘤的先兆。
二、 惡性腫瘤腦轉移的診斷和鑒別診斷
發生腦轉移的常見原發性惡性腫瘤有非小細胞肺癌(NSCLC)、小細胞肺癌 (SCLC) 、乳腺癌、惡性黑色素瘤、結腸直腸癌、腎癌等。一般情況下,腦轉移瘤的估計發病率為:20%的NSCLC患者,50%~80%的SCLC患者,15%的乳腺癌患者,20%~50%的惡性黑色素瘤患者,4%的結直腸癌患者。與特殊實體瘤相關的腦轉移瘤患者數量取決于下列兩個因素:特定原發性腫瘤患者的數量和腫瘤發生腦轉移的趨勢。肺癌是最常見的顱內轉移性腫瘤,肺癌顱內轉移以小細胞肺癌為最多,依次為未分化大細胞癌、腺癌、鱗癌。在確診時約10%小細胞肺癌患者同時伴有腦轉移,經治療后生存2年以上的患者,則腦轉移發生率高達80%。非小細胞肺癌經手術切除后約有1/3因腦轉移而失敗,尸檢證實高達50%以上的患者存在腦轉移,且主要是腺癌。即使病理證實為無肺門、縱隔淋巴結轉移的Ⅰ期NSCLC,在術后3個月內可能有5%的患者出現腦轉移癥狀,提示術前已有無癥狀的微小腦轉移灶存在。
肺癌顱內轉移機理未完全明了。顱內轉移的途徑主要通過血行轉移。肺癌生長速度快,且肺組織血供相當豐富,癌細胞易經肺靜脈進入體循環,隨頸動脈或椎基底動脈上行到腦組織后形成轉移灶。肺癌腦轉移瘤傾向于多發,多發者占70%~86%,單發者僅占14%~30%。80%~85%轉移灶位于大腦, 10%~15%位于小腦,2%~3%位于腦干。腦膜侵犯不如腦轉移常見,多見于小細胞肺癌患者。硬腦膜轉移較軟腦膜多見。癌細胞播散到軟腦膜,經腦脊液擴散,可浸潤皮質、顱、脊神經,同時引起腦脊液循環障礙。轉移灶周圍的腦組織常由于局部機械性壓迫或血供不足,產生缺血、水腫、壞死,甚至出血。較大腫瘤常有中心壞死、囊性變。
(一) 診斷
根據原發惡性腫瘤病史、臨床癥狀和體征以及有關特殊檢查如計算機斷層掃描(CT)或磁共振成像(MRI)等發現顱內占位性病灶,排除原發腦腫瘤和其他腫瘤,臨床診斷腦轉移即可成立。有實體瘤病史者,出現顱內壓增高和/或精神神經癥狀,首先應考慮顱內轉移瘤。在實體瘤的診治過程中,應注意詢問有無顱內轉移引起的臨床癥狀和體征,并進行細致的神經系統檢查,及時請神經內科醫師會診。腦轉移的診斷主要依靠影像學,若有異常應進一步作CT或MRI檢查。對于易發生腦轉移的惡性腫瘤或懷疑有可能存在腦轉移的患者,治療前分期檢查應包括頭顱CT或MRI,以排除僅有實體瘤局部癥狀而無任何顱內高壓癥狀的腦轉移患者。腦轉移診斷成立后需進一步明確轉移范圍及有無顱腦以外的轉移存在,應同時做全身有關檢查,如腹部B超和CT、骨骼ECT掃描等,必要時PET檢查,為進一步治療提供依據。
1. CT:增強CT檢查是目前診斷腦轉移瘤最可靠手段之一。目前,大多數研究的診斷及療效評價以CT為標準。CT能清楚顯示轉移瘤的大小、部位及數目。腦轉移灶在CT平掃時的典型表現為孤立的類圓形團塊,多數為等密度或略低密度,這與腫瘤的細胞成分、血供情況、壞死囊變程度以及是否出血和鈣化有關。注射造影劑增強掃描可使病灶更加清晰。值得注意的是顱腦CT檢查的假陽性率可高達11%,故有人主張CT檢出顱內病變后應行腫瘤活檢。另外,CT對小于0.5cm的病灶和幕下轉移瘤的顯示不滿意。因此,必要時需重復CT檢查或進一步作MRI檢查。
2. MRI:增強MRI對診斷腦轉移最有價值。MRI與CT相比有更佳的軟組織對比度以及可多平面多方位顯示的優點,可更好地分辨顱內的解剖結構。所以MRI較CT更易于早期發現腦轉移,有些腦轉移灶在CT未出現異常時即可顯示。MRI可更好顯示多發灶,很多CT掃描單發者,經MRI檢查證實為多發,且增強后常發現病灶更多,瘤體更大。特別是對幕下轉移灶,MRI較CT更易檢出。
3. 腦脊液檢查:腦脊液中檢到癌細胞是確診軟腦膜受累的可靠依據。腦脊液檢查操作簡單,除嚴重顱內壓增高者不宜作腰椎穿刺除外。但腦脊液陰性病例不能排除腦膜轉移。腦脊液檢查還可用于觀察治療效果。經治療后,部分患者腦脊液中惡性腫瘤細胞消失,腦脊液糖含量升高或恢復正常。
4. 其他檢查:立體定向穿刺活檢是有創性檢查,在CT引導下可準確地對腫瘤部位進行穿刺,獲得病理學證據,排除原發顱內腫瘤,避免誤診誤治;另外,如原發腫瘤已治愈多年,顱內孤立性病灶難以排除轉移癌,或顱內占位性病灶診斷不明者,也可在經選擇的條件下行手術探查確診;腦血管造影曾是神經外科最常見的檢查方法,由于造影引起痛苦較大,操作復雜,且有一定的危險性,病人常難以接受;顱骨平片檢查可發現部分腦轉移瘤同時伴有顱骨轉移,靠近顱骨的轉移瘤,當侵及顱骨時X 線平片可見顱骨骨質破壞甚至瘤結節,頭顱X線上可有顱高壓跡象。腦電圖、腦超聲波檢查、放射性同位素檢查等對于顱內腫瘤的診斷也有一定的參考價值。
(二) 鑒別診斷
診斷腦轉移瘤時應注意與原發性腦瘤,腦膿腫及腦血管病等鑒別,以免誤診。以神經系統癥狀為首發表現,影像學檢查發現單個占位性病灶,首先應排除原發性腦瘤。11%的單發中樞神經系統占位性病變非轉移性,有時需經立體定向穿刺活檢或手術后病理學檢查才能作出明確診斷。晚期惡性腫瘤患者由于凝血機制障礙,亦可發生嚴重腦血管病(如腦內及硬膜下血腫),大腦中動脈內如有大量瘤栓可引起腦軟化,來自肺癌的瘤栓及化膿性栓子可形成轉移瘤內膿腫,這時根據臨床表現和CT檢查往往難以與腦轉移瘤鑒別,從而導致延誤腦轉移瘤的診斷,必要時可行立體定向穿刺活檢、手術探查及腦血管造影檢查。值得注意的是,小細胞肺癌患者也可有神經癥狀,主要癥狀為癡呆、精神障礙,重癥肌無力癥等,肺癌切除后或化療后,以上癥狀可自行消退或緩解。此外,精神神經癥狀尚可出現于水電解質紊亂、低血糖以及有嚴重的心理精神疾病的患者。應避免把可以治療的伴發癥和并發癥誤為腦轉移晚期而過早放棄必要的努力。
三、 當前的治療選擇
無論單發或多發腦轉移瘤處理都比較棘手,當前主要治療方法有手術治療、全腦放療(WBRT)、立體定向放療、化療、原發腫瘤的治療、使用腎上腺皮質激素降低顱內壓減輕腦水腫以及支持治療,其中WBRT是最有效的治療手段。選擇治療方式時要綜合考慮腦轉移病灶數目、原發病灶特征及控制情況、腦轉移復發后的治療以及原發病灶是否已知及得到有效控制等因素。
傳統方法治療下患者的生存獲益有限,中位生存期為4~6個月(表1)。最近一些新藥,如替莫唑胺(TMZ)、莫特沙芬釓(MGd)和Efaproxiral相繼出現,為腦轉移瘤的治療帶來新的希望。
表1 腦轉移瘤患者的中位生存期
|
治療手段 |
中位生存期(月)* |
|
無 |
1 |
|
皮質類固醇激素 |
2 |
|
全腦照射聯合皮質類固醇激素 |
3~6 |
|
外科切除(孤立性腦轉移瘤) |
9~14 |
|
全腦照射聯合放療外科[9] |
11 |
* 自腦轉移瘤診斷至死亡
目前,腦轉移瘤的一線治療無標準措施,治療因地而異。一些國家將外科切除作為一線治療選擇,不能手術切除的腦轉移患者進行放療和化療。例如,意大利常應用放療治療癥狀性腦轉移瘤,而無癥狀患者的一線治療可能是化療,必要時輔以放療。而英國腦轉移瘤的一線治療為化療,放療為二線治療。一般而言,治療決策的依據是患者的體能狀態、腦轉移瘤的數量和部位。影響治療決策的主要因素列舉于表2。
表2 腦轉移瘤治療決策的影響因素
|
參數 |
因素 |
|
患者相關因素 |
體能狀態 |
|
|
神經功能 |
|
|
年齡 |
|
|
癥狀 vs 無癥狀 |
|
決策相關因素 |
孤立性 vs 多發性 |
|
|
新診斷 vs 復發性 |
|
|
腦轉移瘤部位 |
|
|
腦轉移瘤大小 |
(一) 皮質類固醇激素治療
大多數腦轉移瘤患者需要皮質類固醇激素治療,一般選用地塞米松,以減輕腫瘤周圍腦組織的水腫程度。應用皮質類固醇激素的一個主要問題是,患者的免疫系統受到抑制,可能發生特殊類型的肺炎—卡氏肺孢子蟲肺炎(PCP)。因此,患者(尤其是50歲以上)一般需要進行甲氧芐氨嘧啶-磺胺甲基異惡唑預防性治療。
(二) 癲癇的治療和預防
20%~40%的腦轉移瘤患者可能發生癲癇,為預防癲癇再次發作,可進行抗驚厥藥物治療。例如苯妥英、卡巴咪嗪或苯巴比妥。然而,有時沒有任何癲癇跡象的腦轉移瘤患者也需要抗驚厥治療,但這種預防性治療仍有爭議,尤其對于未手術切除的腦轉移瘤患者。
皮質類固醇激素與抗驚厥藥物或患者應用的其他藥物(例如化療藥物)之間可能發生相互作用,導致一種或兩種藥物的療效均下降。例如:苯妥英可加快地塞米松和紫杉醇的代謝,地塞米松可降低苯妥英的血漿濃度。
(三) 手術(顱骨切開術)
根據特殊預后因素選擇患者,則更有可能達到治療目標。手術切除的積極預后因素包括:①孤立性腦轉移。多發性腦轉移瘤手術預后差。②可控制的原發性腫瘤。全身性播散者不適合手術。③KPS體能狀態較好。④原發腫瘤確診與腦轉移瘤確診之間的時間間隔較長,癌癥的初次診斷至隨后腦轉移瘤確診之間的時間間隔成為預后因素的原因是可提供腫瘤侵襲性和腦轉移瘤手術后復發風險的信息。⑤年齡相對較小(<60歲)。
上述預后因素僅為指導性,雖然新診斷孤立性腦轉移瘤是手術切除的最佳指征,但下列情況下,對多發性或復發性腦轉移瘤也可能進行手術切除:患者具有威脅生命的病灶或較大病灶壓迫周圍腦組織引起癥狀
(四) 放療
放療可能是新診斷多發性腦轉移患者的推薦治療措施,但也可用于孤立性腦轉移患者的治療。為判斷腦轉移瘤的預后,腫瘤放療組織(RTOG)根據預后因素(包括體能狀態、年齡和多發性還是孤立性腦轉移灶)將患者分為三類。研究所用的特定分析方法稱為“回歸分割分析-RPA”,因此將基于RPA的分類稱為腦轉移瘤的RTOG RPA分類。表3列舉了三個RPA分類及其相關的中位生存期。
表3 腦轉移瘤患者RPA分類的中位生存期
|
RPA分類 |
描述 |
中位生存期(月) |
|
I |
KPS ≥ 70
年齡< 65 歲
原發腫瘤可控制
無顱外轉移 |
7.1 |
|
II |
KPS ≥ 70
年齡≥ 65歲
原發腫瘤不可控制
其他部位轉移
不滿足I和III類的所有其他患者 |
4.2 |
|
Ⅲ |
KPS < 70 |
2.3 |
KPS=Karnofsky 體能狀態
患者治療目的不同,其放療的實施方法也不同,主要有:①單一放療,或與地塞米松聯合,以緩解腫瘤腦內占位相關癥狀;②術后放療以預防腦轉移瘤復發;③與化療聯合以縮小腫瘤體積;④預防性放療—預防腦轉移,尤其對于腦轉移發病率很高的SC LC患者。
1. 全腦放療(WBRT):遠距離放療常用于實施腦轉移瘤患者的全腦放療,可改善生存期并降低局部復發率。各治療中心的治療計劃均有其特殊性,常用計劃為20 Gy分割為4個5 Gy段和18 Gy分割為6個3 Gy段。有些外科手術切除患者也可進行WBRT,以進一步延長生存期,降低腦內病灶的復發機會。由于大部分SCLC患者會發生腦轉移,因此,在腦轉移發生前可進行預防性顱腦照射(PCI)。腦轉移瘤患者大多死于全身疾病,WBRT后的生存期一般不會太長。然而,WBRT 1年后仍然生存的患者可出現放療相關的遲發性并發癥:①腦萎縮;②組織壞死;③內分泌功能失常;④神經認知功能退化;⑤癡呆。
2. 立體定向放療外科(SRS):放療外科是一種對小范圍治療區域實施高劑量放射的遠距離放療技術,可采用三種技術:①直線加速器—產生高能X線;②伽瑪刀—產生γ射線;③回旋加速器—產生帶電粒子,例如質子,不如前兩種技術常用。
立體定向放療外科是指利用三維計算機程序,將直線加速器或伽瑪刀的放射線引導至腦內病灶所在部位。放療外科實施期間,神經外科醫師和腫瘤放療醫師將共同決定每一患者的最佳治療策略和方法。有時,可聯合應用放療外科與WBRT,以改善局部控制。另外,可使用放射增敏劑使腫瘤細胞對放療的細胞毒作用更加敏感,以增強對腫瘤細胞的殺傷效果。目前,進行中的Ⅲ期試驗正在評估兩種新制劑(莫特沙芬和乙丙昔羅)對腦轉移瘤患者的放療效果增強能力。
(五) 化療
化療并非實體瘤腦轉移的常用治療手段。腦轉移瘤發生于癌細胞由原發部位到腦的傳播,因此,對特定實體瘤如SCLC和乳腺癌,有效的化療藥物也能緩解腦轉移灶。腦轉移瘤也可能發生于原發性腫瘤化療后的緩解期,因此,可能對一線化療藥物抵抗或難治。
假如化療藥物對實體瘤具有抗腫瘤活性,則只要有足量的化療藥物到達腦內,就很可能對腦轉移瘤的癌細胞產生細胞毒作用。化療藥物要成為腦轉移瘤的有效治療措施,必須對原發性腫瘤具有治療活性,且能很好地通過血腦屏障。雖然已證明許多化療藥物對實體瘤具有活性,但由于很多藥物并不能通過血腦屏障,因此在中樞神經系統組織內難以達到理想的濃度。例如,中樞神經系統惡性腫瘤的藥物動力學研究顯示,紫杉醇這一NSCLC患者化療方案的常用藥物到達CSF的濃度僅相當于血漿濃度的0.12%~8.3%。
毛細血管壁僅有一層內皮細胞的厚度,相鄰內皮細胞之間的小縫隙允許體內的大分子通過并進入組織。然而,腦組織中毛細血管周圍的單層內皮細胞之間具有緊密連接,可緊密調節進入腦組織的潛在毒物,這就是所謂的血腦屏障。分子進入并離開腦組織有數種方式:①脂溶性物質經彌散可穿過毛細血管的細胞膜;②氣體分子,例如氧氣和二氧化碳也可彌散穿過細胞膜;③葡萄糖是腦組織的主要能量物質,必須經特殊載體的主動轉運才能進入腦組織。
雖然正常CNS組織具有血腦屏障的功能已被廣泛認可,但有人認為腦轉移瘤可部分程度擾亂血腦屏障功能。在檢查轉移性腦瘤的手術標本時,研究者發現腦轉移組織中的藥物濃度高于以往報道的CSF藥物濃度。因此,有理論認為:腦轉移瘤可造成血腦屏障功能障礙,允許化療藥物通過并進入腦組織和CSF。雖然沒有明確的數據支持或否決上述理論,但有些醫生強烈支持該觀點。
即使患者的原發腫瘤和腦外其他轉移瘤對治療有效,腦轉移瘤復發或進展也并非罕見現象。在這種情況下,無最佳治療選擇,可采取放療外科、手術切除、化療或WBRT等措施治療。然而,WBRT用于復發性轉移瘤的治療具有局限性,即僅可用于腦轉移瘤初次治療期間未行WBRT的患者,因為放療毒性反應具有蓄積性。因此,除患者的年齡、體能狀態、患者和家屬擔憂以及腫瘤內科醫師的偏好外,復發性腦轉移瘤治療的決策依據還應包括患者曾接受治療的模式。
四、 替莫唑胺
替莫唑胺(泰道,TMZ)是新型咪唑四嗪類藥物,在生理 pH 條件下,替莫唑胺可自發轉化為[5-(3-甲基三氮烯-1-)咪唑-4-酰胺](MTIC),通過 DNA 甲基化發揮細胞毒作用O6 鳥嘌呤占總加合物的5%,其細胞毒作用高,而N7 鳥嘌呤、N3 腺嘌呤分別占總加合物的70%和9%,細胞毒作用高低。對人類腫瘤細胞系具有廣譜抗腫瘤活性,10 mM 濃度下對乳腺癌、結腸癌、卵巢癌、前列腺癌、腎細胞癌、黑素瘤、NSCLC及肉瘤等均具有細胞毒作用。口服生物利用度達100%,半衰期為 1.8 小時,重復用藥無蓄積作用。
替莫唑胺發生耐藥的機制有:①O6-烷基鳥嘌呤-DNA-烷基轉移酶(MGMT)。②錯配修復途徑缺陷。DNA 錯配修復蛋白突變:干擾對 O6-甲基鳥嘌呤的識別或導致細胞對 O6-鳥嘌呤甲基化耐受。③核苷剪切修復途徑:DNA 中常見的 N7-甲基鳥嘌呤和 N3-甲基腺嘌呤加合物一般在阻斷 DNA 合成前被去除;核苷剪切修復途徑缺陷增加細胞對替莫唑胺的敏感性。
替莫唑胺的治療指征為惡性膠質瘤,例如多形性膠質母細胞瘤(GBM)和間變性星形細胞瘤(AA)標準治療后復發和進展的患者。除治療原發性腦瘤外,目前正在探討替莫唑胺對實體瘤相關腦轉移的治療作用,例如肺癌、乳腺癌和黑色素瘤。替莫唑胺的臨床研究證明:替莫唑胺可通過血腦屏障,口服給藥后4小時左右,CSF的生物利用度為血漿的40%(圖1)。臨床前研究證明:替莫唑胺對黑色素瘤、卵巢癌、結腸癌、腦瘤、BCNU耐藥性中樞神經系統腫瘤、乳腺癌和非小細胞肺癌具有抗腫瘤活性。
表4比較了替莫唑胺與其他兩種非小細胞肺癌常用化療藥物(紫杉醇和順鉑)的血腦屏障通過能力。
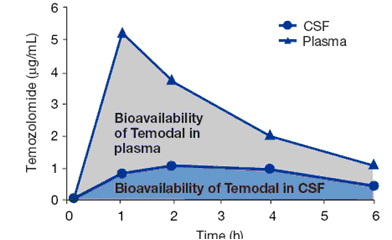
圖1 替莫唑胺在口服給藥后1~2小時進入CSF
表4 腦瘤患者CSF中化療藥物的生物利用度
|
化療藥物 |
給藥途徑 |
占血漿濃度百分比 |
|
替莫唑胺 |
口服 |
40% * |
|
紫杉醇 |
3小時靜脈注射 |
0.12~8.3% |
|
順鉑 |
靜脈注射 |
2.5~7.7% |
Christodoulou等進行的Ⅱ期研究,探討了替莫唑胺(150 mg/m2/d,第1~5天,每28天1周期)對28例實體瘤腦轉移患者的療效。非小細胞肺癌12例,小細胞肺癌5例,乳腺癌4例,黑色素瘤2例,其他實體瘤5例。23例接受過全腦放療,78%的病例接受過1~4個化療方案。27例接受替莫唑胺1療程以上患者的總中位生存期為4.5個月(0.5~15.5個月),中位進展時間為3個月。肺癌、胸膜與心包積液和多發性腦轉移患者有1例(4%)部分緩解。該患者曾接受WBRT、1周期紫杉醇與卡鉑和7周期絲裂霉素-順鉑-長春堿方案治療,結果肺腫瘤部分緩解、胸膜與心包積液完全緩解。隨后因肺原發性腫瘤和腦轉移瘤進展而接受11周期替莫唑胺治療,結果腦和肺臟腫瘤均獲得部分緩解。10例患者(27%)的神經癥狀可能或明確改善,2例患者(7%)無變化。27例患者均參與安全性和毒性反應評估,一般而言,替莫唑胺治療的耐受性良好,不良反應事件為自限性。3例患者報告3級頭痛,4例3級惡心/嘔吐。無其他3/4級毒性反應。
Dardoufas等進行的Ⅱ期研究探討了替莫唑胺聯合同步放療+輔助化療對20例新診斷實體瘤腦轉移患者的作用(表5)。
表5 疾病特征
|
參數 |
患者數量 |
|
孤立性腦轉移瘤 |
6 |
|
多發性腦轉移瘤 |
14 |
|
原發性腫瘤類型
肺癌
直腸癌
乳腺癌
黑色素瘤
|
11
3
3
2
1 |
同步治療期:替莫唑胺60 mg/m2/d + 同步放療3Gy/d分割,每周5天,持續2周 + 6~9Gy加強放療,總劑量為36~39Gy。輔助化療期:替莫唑胺200 mg/m2/d,第1-5天,每周期28天,應用6周期。輔助化療于WBRT后1個月開始(圖2)。

圖2 治療方案
在替莫唑胺輔助化療3和6周期后,經CT掃描評估患者對治療的反應(表6)。本研究中,肺癌腦轉移瘤患者對替莫唑胺聯合同步放療的緩解率高達82%,黑色素瘤腦轉移患者對替莫唑胺完全緩解率為50%。所有腦轉移瘤患者的總緩解率為55%,肺癌患者的緩解率為82%。總臨床獲益率為80%~85%。黑色素瘤腦轉移患者的完全緩解率為50%,肺癌患者為18%。肺癌患者的部分緩解率為64%。隨訪8個月時,14例患者仍然存活,繼續隨訪。
表6 替莫唑胺化療3和6周期后的結果
|
反應 |
3周后反應例數(%) |
6周后反應例數(%) |
|
完全緩解 |
4(20) |
3(15) |
|
部分緩解 |
7(35) |
8(40) |
|
疾病穩定 |
6(30) |
5(25) |
|
疾病進展 |
3(15) |
4(20) |
Antonadou等進行的試驗探討了替莫唑胺聯合同步放療+輔助化療對48例既往未治療腦轉移瘤患者的作用。治療開始時,兩治療組的所有患者均應用激素治療。入組合格性評估要求治療開始1周前,患者的激素應用必須穩定。治療2個月后,替莫唑胺聯合同步放療組患者僅有67%需要激素治療,而單純放療組為91%。45例可評估患者中,添加替莫唑胺可顯著改善放療的緩解率:替莫唑胺聯合同步放療組有96%患者獲得完全緩解或部分緩解,相比而言,單純放療組僅為66%(P=0.017)與單純放療組相比,替莫唑胺聯合同步放療組有更多患者的神經功能改善。治療開始時,聯合治療組和單純放療組分別有24%和26%的患者為完全功能(1級)。治療后,聯合放療組和單純放療組完全功能的患者分別增加到46%和38%。與單純放療組相比,替莫唑胺聯合同步放療組患者的總生存期輕微改善(8.6 vs 7.0個月,P=0.447)。
Mangiameli等探討了兩個以替莫唑胺為基礎的多藥化療方案對新診斷或復發性非小細胞肺癌腦轉移瘤患者的治療作用。
化療A方案(4例):替莫唑胺150 mg/m2/d,第1-5天 + 吉西他濱1000 mg/m2/d,第1,8天 + 順鉑50 mg/m2/d,第1,8天;每周期21天。
化療B方案(4例): 替莫唑胺150 mg/m2/d,第1-5天 + 吉西他濱1000 mg/m2/d,第1,8天 + 長春瑞濱 25 mg/m2/d,第1,8天;每周期21天。
結果3例患者完全緩解,A方案1例,B方案2例。有2例患者因時間短暫而難以評估療效。患者對聯合化療的耐受性良好,無4級毒性反應。主要毒性反應有:2/3級中性粒細胞減少癥(2例)、2/3級貧血(3例)、2級神經毒性(3例)和1級惡心(1例)。
Omuro等探討了替莫唑胺聯合長春瑞濱化療方案對復發性非小細胞肺癌腦轉移瘤患者的治療作用。化療方案為:替莫唑胺150 mg/m2/d,第1~7和第15~21天,每周期28天 + 長春瑞濱15 mg/m2/d,第1,8天(以5 mg/m2的幅度逐漸增加劑量,直到最大耐受劑量)。研究期間,共14例患者入組。10例可評估患者中,4例(40%)臨床獲益,4例患者發生3/4級中性粒細胞減少癥,5例患者發生2/3級血小板減少癥。
此外,全腦放療聯合莫特沙芬釓,患者神經功能惡化時間顯著延遲。Ⅲ期臨床研究顯示,與單純MBRT治療相比,NSCLC腦轉移患者接受MGd和MBRT聯合治療后,神經功能惡化的時間延遲(15.37個月vs.10.03個月),但無統計學意義。亞組分析顯示,北美患者接受MGd和MBRT聯合治療后,神經功能惡化的時間顯著延遲(24.2個月vs.8.8個月, P=0.004)。
盡管這些新藥的療效尚需更多Ⅲ期臨床研究證實,但至少為腦轉移瘤的治療帶來了新的希望。
TAG:替莫唑胺 泰道 腦轉移
相關藥品








