您現在的位置: 百濟新特藥房網首頁 >> 行業資訊 >> 新藥快訊
CDE擬突破性療法認定:信達/馴鹿醫療 BCMA CAR-T 治療R/R MM
- 來源: 百濟藥房藥訊 作者:百濟動態 瀏覽: 發布時間:2021/2/25 16:45:00
國家藥品監督管理局藥品審批中心(CDE)2021年2月23日顯示,由信達生物和馴鹿醫療合作開發的全人源 BCMA 嵌合抗原受體自體 T 細胞注射液(代號:IBI326/CT103A)正式納入「突破性治療藥物品種」,擬定適應癥(或功能主治)為復發/難治性多發性骨髓瘤(R/R MM)。
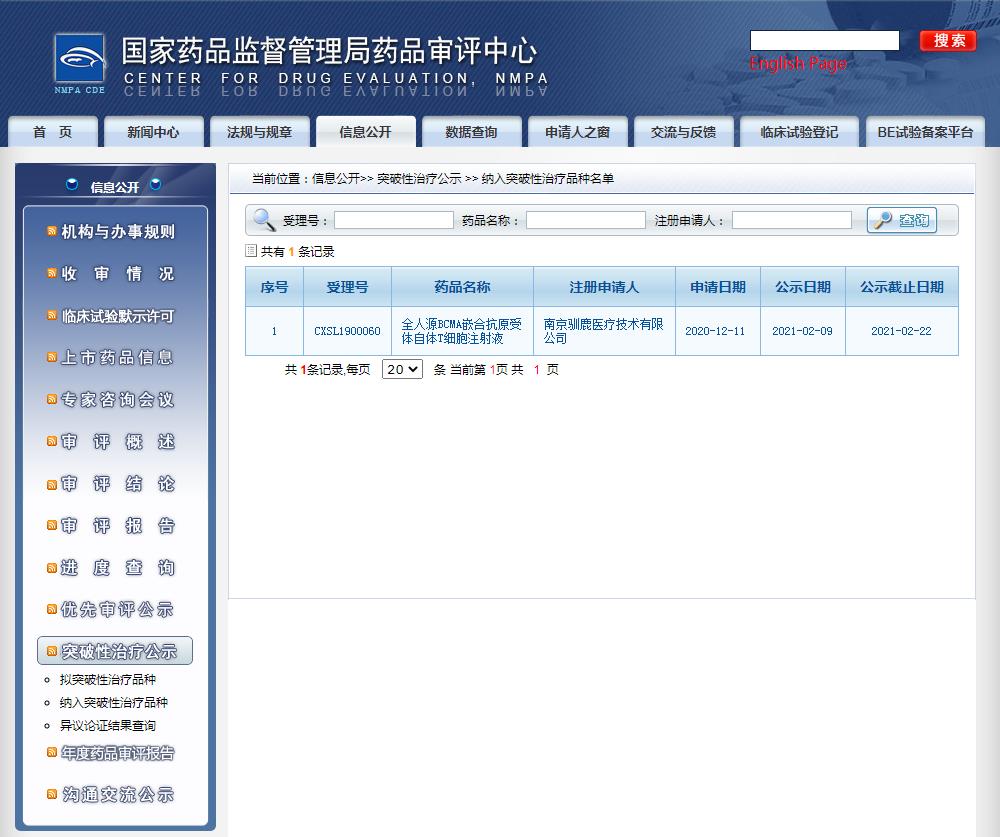
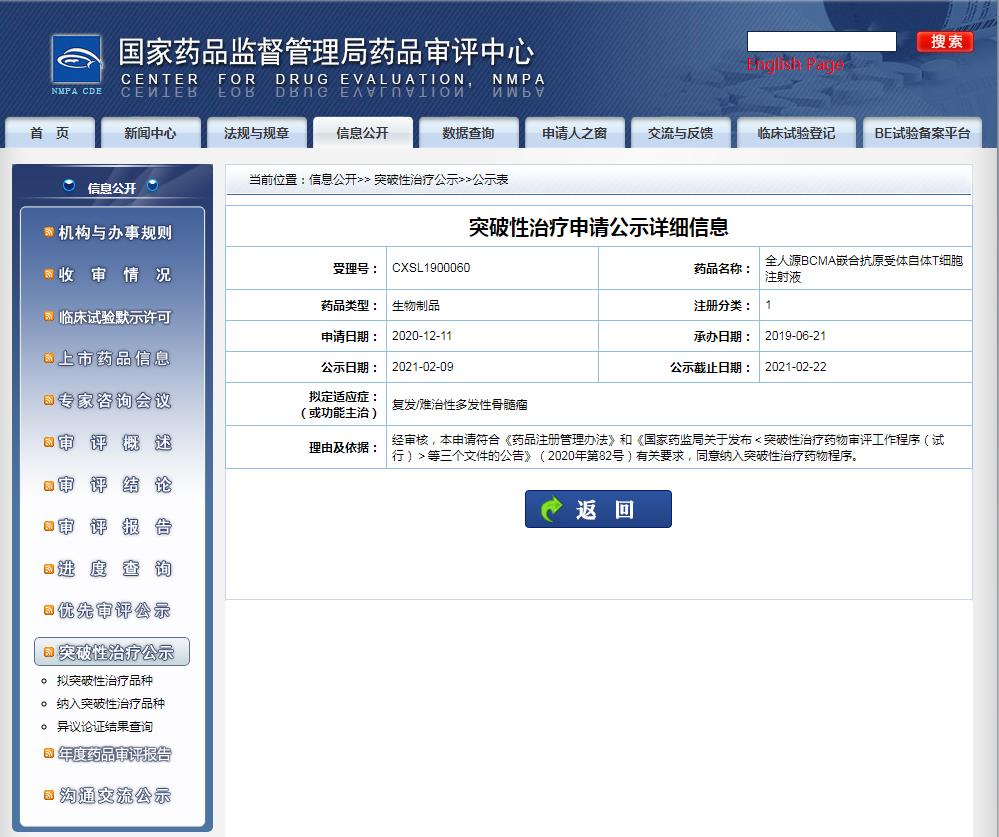
圖片來源:CDE官網截圖
IBI326 是一種針對 B 細胞成熟抗原(BCMA)的 CAR-T 細胞療法,以慢病毒為基因載體轉染自體 T 細胞,CAR 包含全人源 scFv、CD8a 鉸鏈和跨膜、4-1BB 共刺激和 CD3ζ激活結構域。
“IBI326 納入 CDE 突破性治療藥物程序,說明了這一款藥物在治療復發難治多發性骨髓瘤中的潛力,希望這款藥物早日上市,并使更多的患者受益。”,信達生物醫學科學與戰略腫瘤副總裁周輝博士表示。
“此次 CT103A 臨床試驗納入 CDE 突破性治療藥物程序,有望加速這款藥物在中國的研發和審批速度,并能早些幫助到更多的患者。”,馴鹿醫療創始人兼 CEO 張金華表示。
關于多發性骨髓瘤(R/R MM)
多發性骨髓瘤屬于一種克隆性漿細胞異常增殖的惡性疾病,是血液系統惡性腫瘤的一種非常常見的惡性腫瘤。
針對多發性骨髓瘤患者的初始治療,常常采用的一線治療藥物包括蛋白酶體抑制劑、免疫調節類藥物及烷化劑類藥物。對于大多數患者而言,常用的一線治療通常能夠使患者的病情進入穩定階段,但是也會有少部分的患者在初始治療的時候表現出原發耐藥,并且病情難以控制。多發性骨髓瘤一旦進展為復發或者難治階段,這一類患者生存狀況就可能容易變得很差。因此,復發/難治性多發性骨髓瘤患者仍存在未滿足的需求。