原標題:肺癌抗PD-1免疫藥研究招募377名中國患者

藥物研究
研究藥物:Nivolumab注射液,是百時美施貴寶公司(Bristol-Myers Squibb)開發的抗癌免疫藥,它是一種PD-1單克隆抗體。
研究適應癥:晚期或復發性非小細胞肺癌(NSCLC)。
研究標題:一項比較Nivolumab、Nivolumab聯合Ipilimumab、Nivolumab聯合含鉑化療與含鉑化療治療IV期或復發性非小細胞肺癌受試者的開放標簽、隨機3期試驗。
研究目的:比較nivolumab聯合含鉑劑二聯化療與含鉑劑二聯化療的OS。
研究范圍:本研究為國際多中心研究,本次招募計劃,面向全球患者,國內有多家醫療機構(醫院)參與,目標入組人數:總體2211人,中國377人。臨床參加機構(醫院),參見文末列表。
主要入選標準:
1.年齡≥18歲經組織學確診為IV期或復發性NSCLC的患者;
2.必須獲得中心實驗室PD-L1 IHC檢測結果;
3.CT或MRI顯示有適當的可測量病灶;
(詳細說明見下文,終入選標準由醫生評估)
本次臨床招募和實施方案,已經在中國國家食品藥品監督管理總局登記注冊(注冊號:CTR20170340)。按照方案規定,入選患者將隨機分配接受:
●nivolumab(研究組),或
●Nivolumab聯合Ipilimumab(研究組)
●Nivolumab聯合含鉑二聯化療(研究組),或
●含鉑二聯化療(對照組)
(化療供選藥:培美曲塞、紫杉醇、卡鉑、順鉑)
考慮參與或有興趣了解有關研究信息,請訪問文末網址鏈接,獲得更多詳情。符合所有合格性條件(包括入選和排除標準)的患者,在參與臨床研究過程中,將可獲得免費的研究相關檢查和治療。咨詢方式,參見文末的研究人員和醫療機構(醫院)信息。
Ipilimumab(左)和Nivolumab(右)
本次招募的入選標準包括:

排除標準包括:

主要研究者信息:
負責人:吳一龍 主任師
單位名稱:廣東省人民醫院腫瘤中心肺科
(其他主要研究者,參見下表)
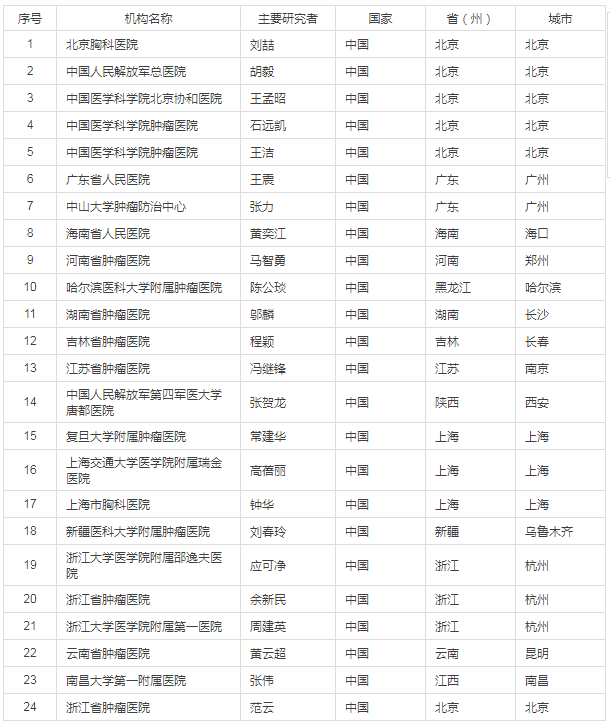
部分中國臨床參加機構(醫院)信息:
來源 :藥明康德/報道
本文為轉載,我們不對其內容和觀點負責。








